sábado, 31 de octubre de 2015
jueves, 22 de octubre de 2015
martes, 20 de octubre de 2015
PRACTICA CALIFICADA
jueves, 15 de octubre de 2015
miércoles, 14 de octubre de 2015
martes, 6 de octubre de 2015
HIDROCARBUROS: ALCANOS
PROPIEDADES FISICAS DE LOS ALCANOS
Los alcanos son compuestos con hibridación sp3 en todos sus carbonos. Los cuatro sustituyentes que parten de cada carbono se disponen hacia los vértices un tetraedro.
Las distancias y ángulos de enlace se muestran en los siguientes modelos.
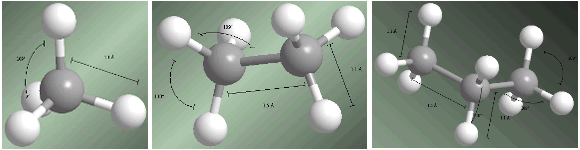
Las distancias y ángulos de enlace se muestran en los siguientes modelos.

Los alcanos de menor tamaño, metano, etano, propano y butano son gases a temperatura ambiente. Los alcanos lineales desde C5H12hasta C17H36 son líquidos. Alcanos de mayor número de carbonos son sólidos a temperatura ambiente.
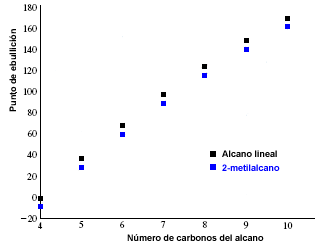
Los puntos de fusión y ebullición de los alcanos aumentan con el número de carbonos de la molécula. También se observa que los alcanos ramificados presentan un punto de ebullición menor que sus isómeros lineales.
En la siguiente gráfica se representan los puntos de ebullición de alcanos lineales (en negro) y los correspondientes a sus 2-metilalcanos isómeros (en azul).
En fase líquida existen fuerzas de atracción entre moléculas que las mantiene unidas. Para pasar a fase gas la sustancia es necesario vencer estas fuerzas intermoleculares mediante el aporte de energía.

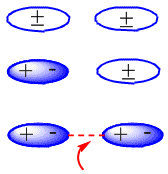
En moléculas neutras, como son los alcanos, las fuerzas atractivas son debidas a interacciones de van der Waals que pueden ser de tres tipos: interacciones dipolo – dipolo, dipolo – dipolo inducido y dipolo inducido – dipolo inducido.
La formación de los dipolos inducidos que producen la atracción entre moléculas neutras puede verse en el siguiente esquema:
Consideremos los isómeros del pentano, como ejemplo de la disminución en el punto de ebullición, al pasar de alcanos lineales a ramificados.
El pentano tiene una importante área superficial que permite gran número de interacciones dipolo inducido – dipolo inducido. El 2-Metilbutano es más compacto y posee menor área superficial, menos interacciones intermoleculares y menor punto de ebullición.
Los puntos de fusión y ebullición de los alcanos aumentan con el número de carbonos de la molécula. También se observa que los alcanos ramificados presentan un punto de ebullición menor que sus isómeros lineales.
En la siguiente gráfica se representan los puntos de ebullición de alcanos lineales (en negro) y los correspondientes a sus 2-metilalcanos isómeros (en azul).

En fase líquida existen fuerzas de atracción entre moléculas que las mantiene unidas. Para pasar a fase gas la sustancia es necesario vencer estas fuerzas intermoleculares mediante el aporte de energía.

En moléculas neutras, como son los alcanos, las fuerzas atractivas son debidas a interacciones de van der Waals que pueden ser de tres tipos: interacciones dipolo – dipolo, dipolo – dipolo inducido y dipolo inducido – dipolo inducido.
La formación de los dipolos inducidos que producen la atracción entre moléculas neutras puede verse en el siguiente esquema:

Consideremos los isómeros del pentano, como ejemplo de la disminución en el punto de ebullición, al pasar de alcanos lineales a ramificados.
El pentano tiene una importante área superficial que permite gran número de interacciones dipolo inducido – dipolo inducido. El 2-Metilbutano es más compacto y posee menor área superficial, menos interacciones intermoleculares y menor punto de ebullición.
Propiedades químicas[editar]
En general, los alcanos muestran una reactividad relativamente baja, porque sus enlaces de carbono son relativamente estables y no pueden ser fácilmente rotos. A diferencia de muchos otros compuestos orgánicos, no tienen grupo funcional.
Solo reaccionan muy pobremente con sustancias iónicas o polares. La constante de acidez para los alcanos tiene valores inferiores a 60, en consecuencia son prácticamente inertes a los ácidos y bases. Su inercia es la fuente del término parafinas (que significa "falto de afinidad"). En el petróleo crudo, las moléculas de alcanos permanecen químicamente sin cambios por millones de años.
Sin embargo, es posible reacciones redox de los alcanos, en particular con el oxígeno y los halógenos, puesto que los átomos de carbono están en una condición fuertemente reducida; en el caso del metano, se alcanza el menor estado de oxidación posible para el carbono (-4). La reacción con el oxígeno conduce a la combustión sin humo; con los halógenos, a la reacción de sustitución. Además, los alcanos interactúan con, y se unen a, ciertos complejos de metales de transición (ver: activación del enlace carbono-hidrógeno).
Los radicales libres, moléculas con un número impar de electrones, desempeñan un papel importante en la mayoría de reacciones de los alcanos, tales como el cracking y el reformado, donde los alcanos de cadena larga se convierten en alcanos de cadena corta, y los alcanos de cadena lineal en los isómeros ramificados, respectivamente.
En los alcanos altamente ramificados, el ángulo de enlace puede diferir significativamente del valor óptimo (109,47°) para permitir a los diferentes grupos suficiente espacio. Esto origina una tensión en la molécula conocida como impedimento estérico, y puede aumentar sustancialmente la reactividad.
Reacciones con oxígeno[editar]
Todos los alcanos reaccionan con oxígeno en una reacción de combustión, si bien se torna más difícil de inflamar al aumentar el número de átomos de carbono. La ecuación general para la combustión completa es:
- CnH2n+2 + (1,5n+0,5)O2 → (n+1)H2O + nCO2
En ausencia de oxígeno suficiente, puede formarse monóxido de carbono o inclusive negro de humo, como se muestra a continuación:
por ejemplo metano:
- CH4 + 2O2 → CO2 + 2H2O
- CH4 + O2 → CO + 2H2O
Ver tabla de calor de formación de alcanos para información detallada.
El cambio de entalpía estándar de combustión, ΔcHo, para los alcanos se incrementa aproximadamente en 650 kJ/mol por cada grupo CH2 en una serie homóloga. Los alcanos de cadena ramificada tienen menores valores de ΔcHo que los alcanos de cadena lineal del mismo número de átomos de carbono, por lo que pueden ser vistos como algo más estables.
Reacciones con halógenos[editar]
Artículo principal: Halogenación radicalaria
Los alcanos reaccionan con halógenos en la denominada reacción de halogenación radicalaria. Los átomos de hidrógeno del alcano son reemplazados progresivamente por átomos de halógeno. Los radicales libres son las especies que participan en la reacción, que generalmente conduce a una mezcla de productos. La reacción es altamenteexotérmica, y puede resultar en una explosión.
Estas reacciones son una importante ruta industrial para los hidrocarburos halogenados.
Los experimentos han mostrado que toda halogenación produce una mezcla de todos los isómeros posibles, indicando que todos los átomos de hidrógeno son susceptibles de reaccionar. Sin embargo, la mezcla producida no es una mezcla estadística: los átomos de hidrógeno secundobromación del propano:5
Cracking[editar]
Artículo principal: Craqueo
El cracking rompe moléculas grandes en unidades más pequeñas. Esta operación puede realizarse con un método térmico o un método catalítico. El proceso de cracking térmico sigue un mecanismo de reacción homolítico con formación de radicales libres. El proceso de cracking catalítico involucra la presencia de un catalizador ácido(generalmente ácidos sólidos como silica-alúmina y zeolitas), que promueven la heterólisis (ruptura asimétrica) de los enlaces, produciendo pares de iones de cargas opuestas, generalmente un carbocatión y el anión hidruro, que es muy inestable.
Los radicales libres de alquilo y los carbocationes son altamente inestables, y sufren procesos de reordenamiento de la cadena, y la escisión del enlace C-C en la posición beta, además de transferencias de hidrógeno o hidruro intramolecular y extramolecular. En ambos tipos de procesos, los reactivos intermediarios (radicales, iones) se regeneran permanentemente, por lo que proceden por un mecanismo de autopropagación en cadena. Eventualmente, la cadena de reacciones termina en una recombinación de iones o radicales.
Isomerización y reformado[editar]
La isomerización y reformado son procesos en los que los alcanos de cadena lineal son calentados en presencia de un catalizador de platino. En la isomerización, los alcanos se convierten en sus isómeros de cadena ramificada. En el reformado, los alcanos se convierten en sus formas cíclicas o en hidrocarburos aromáticos, liberando hidrógeno como subproducto. Ambos procesos elevan el índice de octano de la sustancia.
Otras reacciones[editar]
Los alcanos reaccionan con vapor en presencia de un catalizador de níquel para producir hidrógeno. Los alcanos pueden ser clorosulfonados y nitrados, aunque ambas reacciones requieren condiciones especiales. La fermentación de los alcanos a ácidos carboxílicos es de importancia técnica. En la reacción de Reed, el dióxido de azufre ycloro convierten a los hidrocarburos en cloruros de sulfonilo, en un proceso inducido por luz.
viernes, 2 de octubre de 2015
Suscribirse a:
Entradas (Atom)
